以下內容轉載自《新法家網站》
編者按:
紅果寶公司委托愛爾蘭國立都柏林大學等國內外相關科研團隊,歷經三年,以山楂紅素為原料,在山楂紅素超分子構效機制的聯合攻關研究中取得重大進展。現摘要轉發《國際生物大分子雜志》期刊上發表的學術研究論文《山楂提取物納米顆粒可增強細胞對游離多酚吸收》一文主要內容,以饗讀者。
本研究首次發現,經過組合式熱加工處理后,山楂中的多酚和黃酮等植物活性/藥用成分可自發組裝形成納米級多酚復合結構,命名為“山楂紅素納米顆粒”。通過非靶向與靶向代謝組學質譜技術,初步解析了多酚與納米顆粒骨架間的化學作用機制。這類納米結構不僅有助于提升多酚穩定性,還能通過內吞等機制增強其在腸道中的吸收效率,從而為“中藥炮制”促進藥效提供了分子結構基礎,拓展了中藥 “成分—結構—功能”協同作用的現代科學解釋。此外,當前市售功能性保健品及部分中藥制劑中多采用乙醇等有機溶劑提取純化得到游離多酚,雖廣為使用但生物利用度較低,腸道吸收效率有限。如何提升活性成分在腸道中的穩定性與遞送效率,是功能食品與中藥現代化的重要課題。 本研究揭示了山楂紅素納米顆粒(膠體態)與游離多酚(分子態)在遞送和腸道吸收機制上的顯著差異,以及納米結構在提升生物利用度方面的關鍵作用,為探究山楂紅素等典型食藥同源產品的吸收機制提供了新的理論依據與創新思路。
以下為原文中文版主要內容:

在后疫情時代,全球對功能性食品的需求激增,“食品優先戰略”逐漸獲得廣泛支持,強調通過健康食物和全面營養來預防干預疾病并減少對藥物依賴。山楂(Crataegus spp.)作為“食藥同源”理念的典型代表,因其富含綠原酸、咖啡酸、槲皮素等多酚類化合物,展現出顯著的抗炎、調脂和助消化等多種生物活性。經過傳統加工如炒制,山楂的藥用價值進一步提升,展現出調節血脂、改善胃腸功能和抗炎等作用,并得到了廣泛的臨床試驗證實。然而,盡管已有大量證據表明多酚對健康有益,其游離狀態下的低生物利用度仍是其效果充分發揮的瓶頸,同時這也使得它們難以完全解釋山楂作為中藥的整體療效。
值得注意的是,食物或草藥中的多酚類物質通常不會以單一形式存在,而是通過自組裝形成微納米結構,這些結構通過多酚的多羥基和苯環結構形成的相互作用力(如π-π堆積、氫鍵)驅動。此外,多酚還可能與草藥基質中的其他成分(如多糖、蛋白質等)發生相互作用,這些相互作用可能影響其穩定性和生物利用度。然而,這些相互作用的具體機制,特別是在熱加工條件下對多酚生物利用度的影響,尚未得到系統性研究。
近年來,隨著對中藥傳統加工過程中活性成分結構轉化的關注增加,研究認為,這些加工過程可能伴隨成分的遞送潛力增強,提升藥效的傳統經驗亟待通過現代科學手段加以驗證。事實上,基于植物外泌體的納米遞送系統因其優異的穩定性與靶向性,已成為提升中藥活性成分吸收的研究熱點。然而,相較之下,對于中藥傳統加工過程中所形成的納米顆粒,尤其是炒制和煎煮等工藝中生成的結構,其成分和作用機制尚未被充分認識。草藥中的活性成分通常被細胞膜包裹,難以直接被吸收。為了解決這一問題,傳統中醫通過數千年的發展,已經形成了多種炮制與煎煮方法,使草藥中的成分在高溫作用下與水或其他成分發生物理化學反應,生成的深色化合物(如類黑色素和美拉德產物)有助于提高其溶解度,改變其組成與結構特性,從而增強穩定性、提高藥效并降低毒性。然而,這些微觀結構如何在提高生物利用度方面發揮作用的機制,仍需要進一步的系統研究。
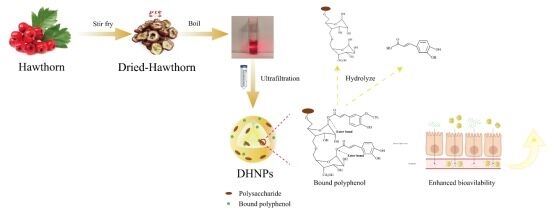
圖1. DHNPs的形成及其提升多酚生物利用度的示意圖。
這一研究以紅果寶山楂紅素為研究對象,圍繞“炮制誘導—結構組裝—多酚緩釋—促進吸收”幾個環節展開討論。

以傳統炮制工藝處理山楂,結合離心、超濾和凍干等步驟獲得DHNPs,通過粒徑、形態和成分表征得知DHNPs是以果膠類多糖(主要為HG型果膠)和多酚為主體的球形納米結構,通過皂化水解結合代謝組學分析證實其高量負載多酚類化合物(~25% wt.)。體外模擬釋放結合釋放動力學模型表明DHNPs負載的多酚具有緩釋特性,其釋放過程符合一級和Korsmeyer-Peppas動力學模型。在Caco-2單層細胞模型中,DHNPs負載多酚的細胞吸收率為游離多酚近兩倍,并基于特異性胞吞抑制劑初步探明DHNPs可通過巨胞飲和Caveolin介導的內吞作用進入細胞,增強腸道細胞對多酚類化合物的攝取,表面食藥同源納米顆粒可作為增強活性成分吸收利用的潛在途徑。 注:山楂紅素樣品由紅果寶公司按統一性標準制備。
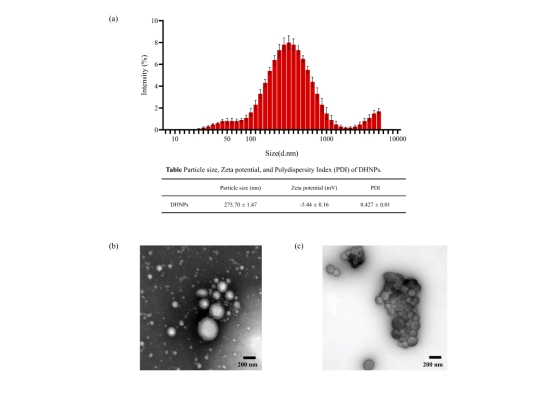
圖2. DHNPs的粒徑分布、Zeta電位、多分散性指數(PDI)和微觀形態。
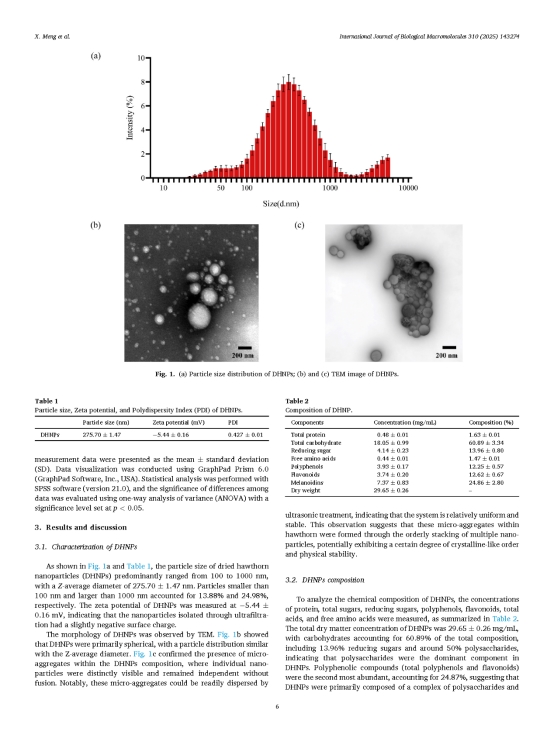
研究團隊使用激光粒度分析儀(Zetasizer Nano ZS90)測得DHNPs的粒徑主要集中于100–1000 nm范圍內,呈中等聚集特征。小于100 nm和大于1000 nm的粒子分別占13.88%和24.98%,提示樣品中既包含部分較小的單體粒子,也存在一定比例的較大聚集體。Zeta電位為-5.44 ± 0.16 mV,表明通過超濾法分離的納米粒子表面帶有輕微的負電荷,具有一定的膠體穩定性。通過透射電子顯微鏡(TEM)觀察了DHNPs的微觀結構,圖像顯示DHNPs主要呈近似球形形貌,輪廓清晰,尺寸分布較為均一;部分粒子呈現分散狀態,未見融合,表明其具備較好的物理獨立性。此外,可觀察到部分區域存在由多個顆粒有序排列形成的聚集結構,呈現一定的三維堆積態,同時發現這些結構可在超聲處理后恢復為單分散粒子,這可能反映出顆粒間存在一定程度的結晶性趨勢。

表1. DHNPs的化學成分測定。
研究團隊為了分析DHNPs的化學成分,通過化學法測定了蛋白質、總糖、還原糖、總酚類、黃酮類、總酸、游離氨基酸和類黑精的濃度(表1)。結果顯示DHNPs的主要成分為多糖和多酚。值得注意的是,化合物成分總含量超過了100%,表明這些成分并非以獨立形式存在,而是作為復合物存在。此外,DHNPs中的酚類化合物占比近25%,顯示其作為多酚納米遞送體系的潛力。
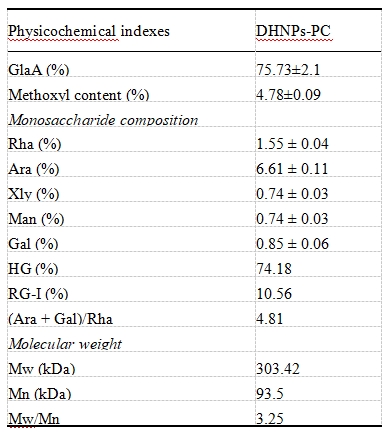
表2. DHNPs果膠的甲氧基含量、分子量和單糖組成測定。
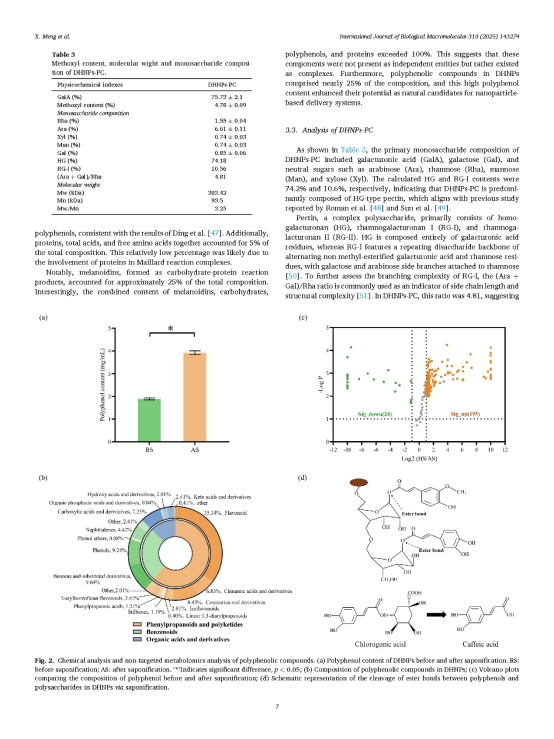
研究團隊對DHNPs果膠的主要單糖進行了分析(表2)。結果顯示,DHNPs果膠主要由HG型和RG-I型果膠組成,含量占比分別為74.2%和10.6%。HG完全由半乳糖醛酸殘基構成,而對于RG-I,(Ara + Gal)/Rha可作為側鏈長度和結構復雜度的指標,其比值為4.81,表明DHNPs的RG-I型果膠側鏈較短,分支較少,這使其整體結構更接近HG型果膠。結果顯示DHNPs在多項抗氧化能力測試(FRAP、ABTS、DPPH、ORAC)中表現出遠高于常見新鮮水果的自由基清除能力。提示DHNPs在熱加工過程中形成的納米結構可能通過與多糖的相互作用,穩定并保護多酚類化合物,減少其降解,從而增強其抗氧化能力。
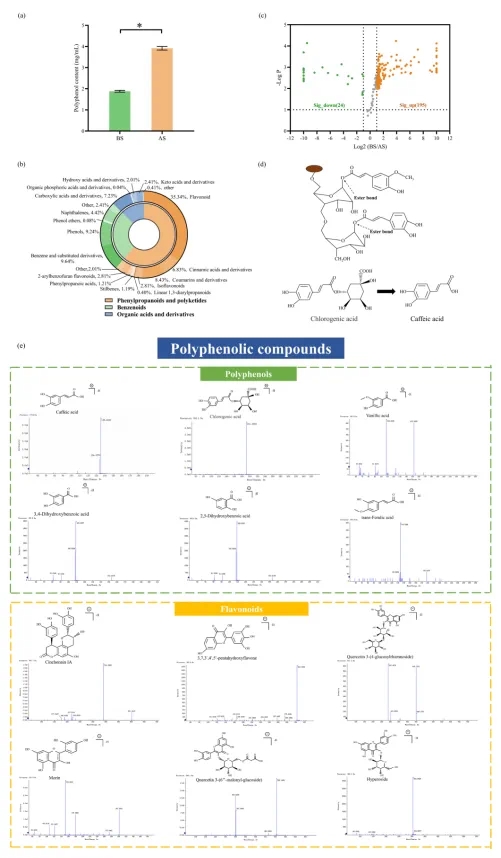
圖3-4. 皂化處理促進了多酚的釋放并通過代謝組學分析揭示了多酚的種類。(a) DHNPs皂化前后多酚含量。BS:皂化前;AS:皂化后。‘*’表示顯著差異,p < 0.05;(b) DHNPs中多酚化合物的組成;(c) 比較皂化前后多酚組成的火山圖;(d) 通過皂化作用切斷DHNPs中多酚與多糖之間酯鍵的示意圖;(e) DHNPs中主要典型酚類化合物的二級質譜圖。
研究團隊為了探究DHNPs中多酚的存在形式,通過皂化水解結合代謝組學方法對其進行分析。結果顯示,多酚濃度在皂化后增加近一倍(圖3a),表明超過一半的多酚以共價結合的形式存在于DHNPs中。提示皂化前檢測到的多酚主要通過氫鍵、疏水作用等弱相互作用吸附在DHNPs表面,而皂化后釋放的結合型多酚則通過酯鍵與多糖連接存在于DHNPs內部。UPLC-QTOF-MS/MS共鑒定出252種生物活性植物化合物,其中酚類化合物(包括黃酮類)占總成分的35%以上(圖3b)。火山圖(圖3c)展示皂化前后多酚化合物組成的變化,顯示大多數酚類化合物在皂化后含量增加,包括咖啡酸、金絲桃苷、(-)兒茶素、2,5-二羥基苯甲酸、反式阿魏酸等。皂化反應破壞了DHNPs基質與多酚之間的酯鍵及其他共價鍵(圖3d),導致眾多酚類化合物釋放,進一步證實了DHNPs中共價結合多酚的存在。

圖5. 游離多酚、DHNPs及DHNPs/游離多酚物理混合物的XRD光譜。
研究團隊為了驗證DHNPs中多酚的存在狀態,采用XRD分析了純咖啡酸、DHNPs以及咖啡酸與DHNPs的簡單物理混合物的結晶度。結果表明,純咖啡酸的XRD圖譜在2θ范圍5-30°內呈現出多個特征性窄峰,表現出較高的結晶度。其與DHNPs的簡單物理混合仍顯示咖啡酸的特征峰,盡管強度有所降低。而對于DHNPs本身的XRD圖譜,則未觀察到明顯的特征性衍射峰,表明DHNPs負載的多酚以無定形(非結晶)狀態存在,DHNPs的結構改變了其內部多酚結晶狀態。

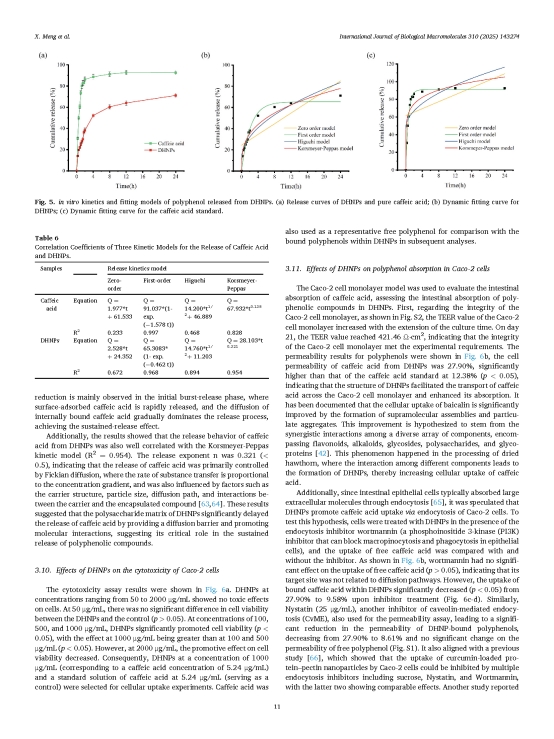
圖6. DHNPs負載多酚的緩釋特性及釋放動力學機制。
研究團隊為了評估DHNPs負載多酚的釋放特性,進行了體外膜透析實驗。結果顯示(圖6a),游離咖啡酸的釋放率在0–2小時內爆發增長,超過85%, 24小時的累積釋放率達92.6%。相比之下,DHNPs負載的咖啡酸的釋放速率明顯低于游離咖啡酸,4小時的累積釋放率僅為50%,24小時的釋放率為71.2%。這些結果表明DHNPs具有多酚緩釋特性。為了進一步闡明釋放機制,采用零級(Zero-order)、一級(First-order)、Higuchi和Korsmeyer-Peppas動力學模型進行擬合分析(圖6b-c)。結果表明,雖然游離咖啡酸和DHNPs的釋放行為都高度符合一級動力學模型(釋放速率與未釋放物質的剩余量成正比),但是游離咖啡酸的K1值為1.578,顯著高于DHNPs負載的咖啡酸(0.462)。這一差異主要歸因于DHNPs與咖啡酸之間的物理包埋和化學鍵作用,多糖基質形成的納米顆粒結構可能充當擴散屏障,并與大部分咖啡酸共價結合,降低咖啡酸從載體中的釋放速率。另外,從釋放曲線的分析來看,這種降低主要體現在初始爆發式釋放階段,即表面吸附的咖啡酸快速釋放,而內部結合的咖啡酸擴散逐漸占主導地位,從而實現緩釋效果。
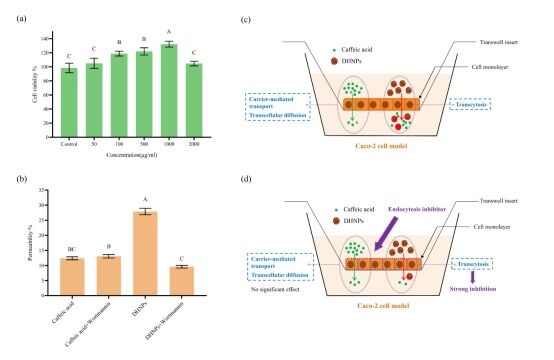
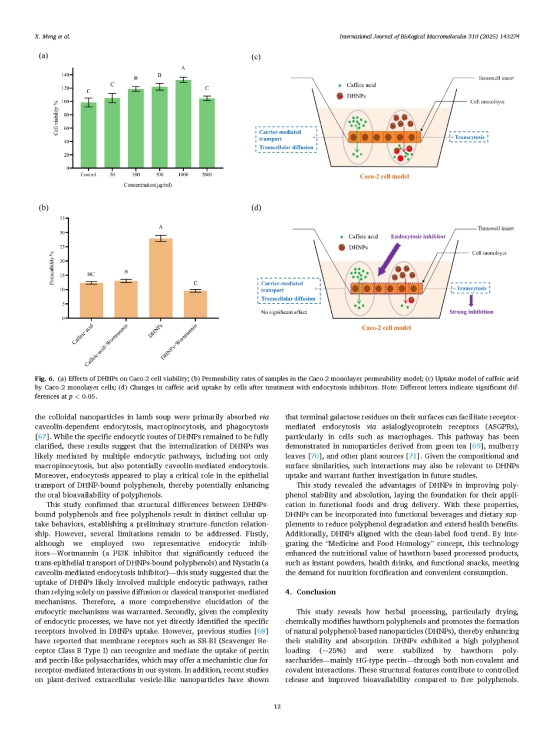
圖7. DHNPs提升細胞活力及其促進多酚生物利用度的機制。(a) DHNPs對Caco-2細胞活力的影響;(b) 樣品在Caco-2單層透過模型中的透過率;(c) 咖啡酸在Caco-2單層細胞中的攝取模型;(d) 處理內吞作用抑制劑后細胞對咖啡酸攝取的變化。
研究團隊通過Caco-2細胞模型評估了DHNPs的細胞毒性及其負載多酚的細胞透過率。細胞毒性實驗結果顯示(圖7a),在50–2000 μg/mL的濃度范圍內,DHNPs對細胞無毒性作用,并在100、500和1000 μg/mL濃度下顯著增加了細胞活力(p < 0.05),以1000 μg/mL濃度最為明顯。Caco-2單層細胞滲透性實驗結果顯示(圖7b),DHNPs負載咖啡酸的透過率為27.90%,顯著高于游離咖啡酸(p < 0.05),表明DHNPs的結構有助于咖啡酸跨越Caco-2單層細胞而增強吸收。為了進一步探究DHNPs的運輸機制,研究團隊使用Wortmannin、Nystatin兩種內吞抑制劑處理細胞,結果顯示DHNPs負載咖啡酸的透過率均出現顯著下降(p < 0.05),而游離咖啡酸在抑制劑處理前后無明顯變化,這表明DHNPs進入細胞的方式并非游離多酚的擴散相關途徑,其跨細胞轉運依賴巨胞飲和caveolin介導的內吞機制。

總結
這一研究在傳統中藥炮制理論與現代納米科技之間架起了橋梁,系統揭示了山楂在“炮制”過程中自發形成的多酚基納米顆粒(DHNPs),在提升多酚生物利用度方面的結構基礎與作用機制,構建了“結構—功能耦合”的遞送新模型。其核心包括:
結構基礎:DHNPs主要由多酚與果膠類多糖(以HG型果膠為主)共組裝形成粒徑約275.7 nm的納米顆粒,兩者通過共價與非共價方式緊密復合,構建出穩定包埋活性成分并具備可控釋放能力的納米結構。
緩釋特性:DHNPs展現出良好的緩釋性能,其負載多酚的釋放行為高度符合一級動力學模型和Korsmeyer-Peppas動力學模型,實現持續、穩定釋放。
提高生物利用度:DHNPs負載咖啡酸在Caco-2單層細胞模型中的吸收率達到27.90%,是游離態的兩倍以上。特異性胞吞抑制實驗進一步確認其吸收過程依賴巨胞飲和Caveolin介導的主動內吞機制,增強腸道細胞對多酚類化合物的攝取。
總之,DHNPs兼具良好的結構穩定性、緩釋能力和細胞吸收促進作用,展現出作為天然、綠色、無需修飾的植物源遞送系統的廣闊應用前景。這一研究為利用天然多糖構建遞送載體、提升多酚生物利用度提供了新思路,也為草藥基功能性食品的開發和中藥活性成分的精準輸送提供了應用案例。

以下為英文原文內容:
英文版第一頁








英文版第二頁